目次 / Index
- 異種細胞融合 / Xenogenic cell fusion
- 筋芽細胞の融合 / Fusion of myoblast
- 異種融合筋管の作出 / Generating xenogenic hybrid myotube
- 参考文献 / References
本研究は、鏡味裕先生 (信州大学農学部) との共同研究です。
This study is the collaboration with Dr Hiroshi Kagami (Faculty of Agriculture, Shinshu University).
異種細胞融合 / Xenogenic cell fusion
細胞融合は、新しい性質を持つ雑種細胞や雑種生物の創出に重要な技術です。異種細胞融合は、センダイウイルス (Okada 1962)、ポリエチレングリコール (PEG) (Pontecorvo 1976)、電気穿孔 (Zimmermann 1981) などの方法で誘導できます。最も成功した異種細胞融合の例は、骨髄腫 (ミエローマ) と抗体産生 B 細胞を融合させたハイブリドーマでしょう (Kohler 1975)。しかし、既存の融合技術はときに、簡便性、効率性、拡張性に劣ります。私たちは、多細胞生物で自然に生じる細胞融合現象を応用することで、これらの問題を解決できないかと考えました。
Cell-cell fusion is an important technology to create novel hybrid cells and organisms. Xenogenic cell fusions can be induced by Sendai virus (Okada 1962), polyethylene glycol (PEG) (Pontecorvo 1976), or electroporation (Zimmermann 1981). The most successful application is hybridomas, the fusion products of myelomas and antibody-producing B cells (Kohler 1975). However in some cases, the current fusogenic approaches are not convinient, efficient, and scalable. We considered that the spontaneous phenomena occured in multicellular organisms may help to solve these problems.
筋芽細胞の融合 / Fusion of myoblast
私たちは、自律的に細胞融合して多核の筋管を形成する、骨格筋芽細胞に着目しました。過去の研究で、PEG によるラット筋芽細胞株とニワトリ筋芽細胞の異種融合の誘導が報告されていますが、自発的な異種融合についての記載はありません (Wright 1981, Konieczny 1982)。近年、骨格筋特異的に発現する膜タンパク質 myomaker が、脊椎動物の筋芽細胞の融合に必須であること報告されました (Millay 2013, Landemaine 2014, Luo 2015)。Myomaker を発現させた線維芽細胞は筋芽細胞と融合することから、myomaker が筋管形成に不可欠であることがわかります (Millay 2013)。脊椎動物の myomaker のアミノ酸配列は高度に保存されており、マウスとニワトリの配列は 85.1% で一致します。このことから私たちは、マウス筋芽細胞とニワトリ筋芽細胞は自発的に融合し、多核の異種ハイブリッド筋管を形成するのではないかと考えました。
We focused on skeletal muscle myoblasts which autonomously fuse to form multinuclear myotubes. Previous studies reported the PEG-induced xenogenic fusion of rat myoblast cell line and chicken myoblasts, however, there are no description about spontaneous xenogenic fusion (Wright 1981, Konieczny 1982). Recent studies reported that skeletal muscle-specific transmembrane protein, myomaker, is essential for myoblast fusion in vertebrates (Millay 2013, Landemaine 2014, Luo 2015). Fibroblasts expressing myomaker can fuse to myoblasts, which demonstrate that myomaker is indispensable for myotube formation (Millay 2013). Amino acid sequences of myomaker are well conserved in vertebrates; the identity between mouse and chicken is 85.1%. We thus considered that murine and chicken myoblasts spontaneously fuse each other to form multinuclear xenogenic hybrid myotubes.
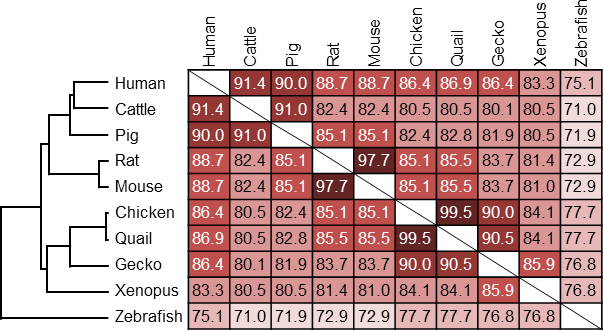
Fig 1. Myomaker のアミノ酸配列 / Amino acid sequences of myomaker
(数字は配列の一致率 / Numerals indicate the identities of sequences)
異種融合筋管の作出 / Generating xenogenic hybrid myotube
異種融合における筋芽細胞の動態を追跡するため、私たちは、緑色蛍光タンパク質 GFP を導入したマウス筋芽細胞 (mMB-GFP) と、赤色蛍光タンパク質 DsRed を導入したニワトリ筋芽細胞 (chMB-DsRed) を作成しました。mMB-GFP と chMB-DsRed を共培養すると、翌日には GFP と DsRed の両方を発現する多核の筋管が観察されました。この GFP+/DsRed+ 筋管は、mMB-GFP と chMB-DsRed が融合して形成された、マウスとニワトリの異種融合筋管だと考えられます。本研究は、哺乳類と鳥類の自律的な異種細胞融合の最初の報告となります (Takaya 2017)。
To trace the dynamics of myoblast during xenogenic fusion, we generated mMB-GFP and chMB-DsRed that are the murine myoblasts expressing green fluorescent protein (GFP) and the chicken myoblasts expressing Discosoma red fluorescent protein (DsRed), respectively. 1 day after the coculture of mMB-GFP and chMB-DsRed, the multinuclear myotubes expressing both GFP and DsRed were observed. These GFP+/DsRed+ myotubes are considered to be the xenogenic hybrid myotubes of mouse and chicken formed by the fusion of mMB-GFP and chMB-DsRed. This is the first evidence for antonoumous xenogenic cell fusion between mammals and aves (Takaya 2017).
Fig 2. マウスとニワトリの異種融合筋管 / Xenogenic hybrid myotube of mouse and chiken (Scale, 50 um)
Fig 3. 成熟した異種融合筋管 / Matured xenogenic hybrid myotube (Scale, 200 um)
参考文献 / References
Kohler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. 1975; 256: 495-497.
Konieczny SF, Coleman JR. Analysis of the expression of chicken and rat gene products in myoblast x myoblast cell hybrids. Exp Cell Res. 1982; 142: 247-260.
Landemaine A, Rescan PY, Gabillard JC. Myomaker mediates fusion of fast myocytes in zebrafish embryos. Biochem Biophys Res Commun. 2014; 451: 480-484.
Luo W, Li E, Nie Q, Zhang X. Myomaker, regulated by MYOD, MYOG and miR-140-3p, promotes chicken myoblast fusion. Int J Mol Sci. 2015; 16: 26186-26201.
Millay DP, O'Rourke JR, Sutherland LB, Bezprozvannaya S, Shelton JM, Bassel-Duby R, Olson EN. Myomaker is a membrane activator of myoblast fusion and muscle formation. Nature. 2013; 499: 301-305.
Okada Y. Analysis of giant polynuclear cell formation caused by HVJ virus from Ehrlich's ascites tumor cells. I. Microscopic observation of giant polynuclear cell formation. Exp Cell Res. 1962; 26: 98-107.
Pontecorvo G. Polyethylene glycol (PEG) in the production of mammalian somatic cell hybrids. Cytogenet Cell Genet. 1976; 16: 399-400.
Takaya T*, Nihashi Y, Kojima S, Ono T, Kagami H. Autonomous xenogenic cell fusion of murine and chick skeletal muscle myoblasts. Anim Sci J. 2017; 88: 1880-1885.
Wright WE. Synthesis of rat myosin light chains in heterokaryons formed between undifferentiated rat myoblasts and chick skeletal myocytes. J Cell Biol. 1981; 91: 11-16.
Zimmermann U, Scheurich P. High frequency fusion of plant protoplasts by electric fields. Planta. 1981; 151: 26-30.

