Introduction
チミジンの類縁体である EdU (5-ethynil-2'-deoxyuridine; 5-エチニル-2'-デオキシウリジン) は DNA に取り込まれるため、EdU 存在下でゲノム DNA を合成した (分裂増殖した) 細胞の核を EdU で標識することができる。
Materials
- 培養液
- Click-iT EdU Alexa Fluor Imaging Kit (Thermo, C10337)
- 10 mM EdU stock, -20°C @培養室
- 1× Click-iT reaction buf, 4°C
- CuSO4, 4°C
- Alexa Fluor, -20°C
- 10× reaction buf additive, -20°C
- PBS(-), 染色用, RT
- 0.01% Triton in PBS(-), 4°C
- 0.2% Triton in PBS(-), 4°C
- 2% PFA in PBS(-), 4°C
- DAPI in PBS(-), 4°C
- マウンティングメディウム (ibidi, ib50001), 4°C
- PAP ペン
- カバーガラス (22×22 mm)
Protocol: 3 cm dish
EdU 処理
- EdU stock を培養液で 1/100 に希釈し、100 uM EdU 溶液を調製する。
- 培養中の培養液に 1/10 量の EdU 溶液 (最終希釈率 1/1000, 終濃度 10 uM) を加える。
細胞の増殖速度が変わるので、培地交換はしない。 - CO2 インキュベーション, 37°C, 1-6 h。
マウス筋芽細胞は 3 h で 20-30% の細胞が EdU 陽性、
ニワトリ筋芽細胞は 3 h で 30% (卵用鶏) - 50% (肉用鶏) が EdU 陽性 (Nihashi 2019)。
EdU 染色
- 1 ml の PBS(-) で wash, 2回。
- 1 ml の 2% PFA を加えて固定する。RT, 5 min。
- 1 ml の 0.01% Triton で wash, 2回。
0.01% Triton に浸した状態で、4°C で保存可能。 - 1 ml の 0.2% Triton を加えて透過処理 (細胞膜に孔を開ける)。RT, 5 min。
- 1 ml の 0.01% Triton で wash, 1回。
- 細胞が 0.01% Triton に浸かっている状態で、以下の EdU 染色液を調製する。
各反応成分は、必ず表の順番で加え、加えるごとによく撹拌する。
| Total | 500 ul | 1000 ul | 1500 ul | 2000 ul |
|---|---|---|---|---|
| 1× Click-iT reaction buf | 430 ul | 860 ul | 1290 ul | 1720 ul |
| CuSO4 | 20 ul | 40 ul | 60 ul | 80 ul |
| Alexa Fluor | 1.2 ul | 2.4 ul | 3.6 ul | 4.8 ul |
| 10× reaction buf additive | 50 ul | 100 ul | 150 ul | 200 ul |
- 0.01% Triton を除去し、PAP ペンで dish の外周をマスクする。
- 200 ul の EdU 染色液を加える。
- アルミホイルで遮光してインキュベーション, RT, 30 min。
- 200 ul の 0.01% Triton で wash, 2回。
- 200 ul の DAPI を加える。
- インキュベーション, RT, 5 min。
- DAPI を除去し、マウンティングメディウムを 1-2 滴垂らす。
- カバーガラスで封入する。
- 顕微鏡で観察・撮影する。
Examples
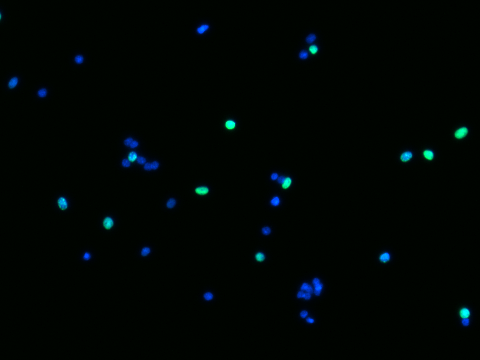
Fig 1. EdU / DAPI
References
Nihashi Y, Umezawa K, Shinji S, Hamaguchi Y, Kobayashi H, Kono T, Ono T, Kagami H, Takaya T*. Distinct cell proliferation, myogenic differentiation, and gene expression in skeletal muscle myoblasts of layer and broiler chickens. Sci Rep. 2019; 9: 16527.

